
Физический мир
Рейтинг изотопов. Всё, что вы не знали об изотопах: самый редкий / самый дорогой / самый востребованный / самый стабильный и даже самый лёгкий.
Немного теории на заметку
Возможно, все читатели «Вестника» прекрасно знают основы ядерной физики и отлично разбираются в терминологии и свойствах химических элементов. Но мы позволим себе напечатать пару абзацев, объясняющих теорию.
Изото́пы (от др.-греч. ισος — равный, одинаковый, и τόπος — место). Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Все изотопы одного элемента имеют одинаковый заряд ядра (то есть количество протонов в нём), отличаясь лишь числом нейтронов.
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди с 1910 года стали называть изотопами.
Различают устойчивые (стабильные) изотопы и радиоактивные изотопы. Только ядра атомов радиоактивных изотопов подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада). В настоящее время известно почти три тысячи изотопов химических элементов, как природных, так и искусственно синтезированных. Для всех элементов искусственно получены радиоактивные изотопы. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка.
Впервые в 1934 году И. Кюри (см. ЖОЛИО-КЮРИ Ирен) и Ф. Жолио-Кюри (см. ЖОЛИО-КЮРИ Фредерик) получили искусственным путем радиоактивные изотоп азота (13N), кремния (28Si) и фосфора (30P), отсутствующие в природе. Этими экспериментами они продемонстрировали возможность синтеза новых радиоактивных нуклидов.
Приведём в пример водород, который имеет три изотопа, из них два стабильны и один радиоактивен:
Водород 1 – протий — этот нуклид называют иногда протием, у него один протон – стабилен
Водород 2 – дейтерий — нуклид, ядро которого состоит из одного протона и одного нейтрона – стабилен
Водород 3 – тритий — один протон и два нейтрона.
Из всех известных изотопов только изотопы водорода имеют собственные названия. И свойства этих изотопов заметно отличаются. Тритий получают искусственно при ядерных реакциях.
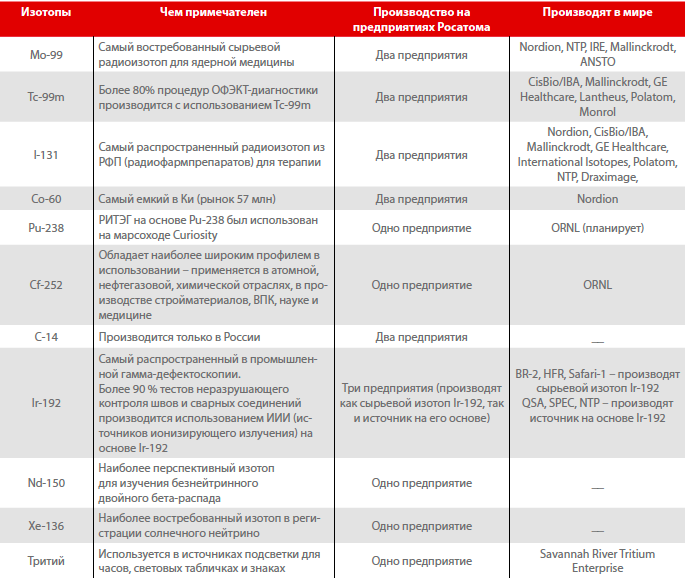
Рейтинг подготовлен при помощи специалистов ОАО «В/О «Изотоп»
Интересные факты
Даже человеческий организм имеет некоторое количество радиоактивных изотопов. Попадают они внутрь через пищу в виде изотопов углерода, который, в свою очередь, впитывается растениями из почвы или воздуха и переходит в состав органических веществ в процессе фотосинтеза. Поэтому и человек, и животные, и растения излучают определенный радиационный фон. Источниками, которые способствуют образованию изотопов, выступают внутренние слои земного ядра и излучения из космоса.

Самый долгоживущий из трансурановых элементов
Pu-244 обладает периодом полураспада 82,8 млн лет.
Самый легкий и самый тяжелый изотопы
Самый легкий нуклид – водород 1, или протий.
Самый тяжелый – унунбий-277 (Uu 277), открытый в феврале 1996 года (выделить хоть сколько-нибудь значимое количество унунбия не удалось и, возможно, никогда не удастся. Это связано с тем, что элемент распадается, испуская α-частицы, с периодом полураспада приблизительно в 1/240-миллионную долю секунды).
Наиболее и наименее стабильные изотопы
Самый стабильный радиоактивный изотоп — теллур 128 (Те-128), период полураспада которого равен 1,5х1024 лет.
Наименее стабильный изотоп – литий-5, который распадается за 4,4х10 – 22 секунды.
Самый пластичный элемент
1 грамм золота (Аu) можно растянуть в длину на 2,4 км.
Наиболее распространенные элементы
Водород – самый распространенный элемент как во Вселенной (свыше 90%), так и в Солнечной системе (70,68%).
Железо – самый распространенный элемент на Земле (36% массы), а свободный азот (N2) – самый распространенный элемент земной атмосферы (78,08% объема, или 75,72% массы).



